Los actínidos, son una serie de elementos que se encuentran en la tabla periódica formando parte del período 7. Junto a los lantánidos, estos elementos son llamados de transición interna. Los elementos químicos que pertenecen a esta serie son 15. Todos estos elementos poseen características similares. Como por ejemplo, tienen un número atómico alto y algunos se encuentran en cantidades mínimas en la naturaleza. Algunos con tiempos de vida relativamente cortos, como es el caso de Uranio. Otra característica importante, es que todos sus isotopos son radioactivos. A continuación, más detalles.
Índice
Ubicación en la tabla periódica
Esta serie se encuentra ubicada en la parte inferior de la tabla periódica, fuera del cuerpo principal de la misma. Ya que, posee un gran número de elementos, al igual que los lantánidos. Esto da origen a una tabla un poco más compacta la cual se situaría en medio del bloque s y el d. Sin embargo, en otras tablas puede visualizarse esta disposición dando origen a una tabla de mayor longitud. Contando al Itrio y al Escandio que no pertenecen a ninguna serie, la familia IIIB presenta la mayor cantidad de elementos químicos. Reuniendo en sí 15 actínidos y 15 lantánidos, lo que en total da como resultado 32 elementos.
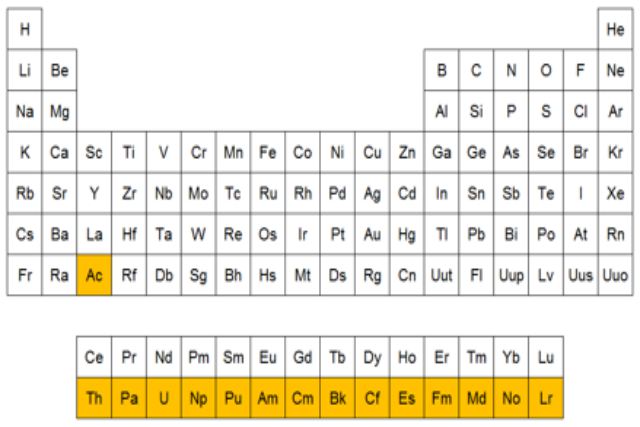
Esta serie se encuentra ubicada en la parte inferior de la tabla periódica, fuera del cuerpo principal
Estos son los elementos actínidos del 89 al 102: Características del Actinio, Torio, Protactinio, Uranio, Neptunio, Plutonio, Americio, Curio, Berkelio, Californio, Einstenio o Atenio, Fermio, Mendelevio, Nobelio o Unnilbio
Propiedades generales de la serie
La serie de los actínidos, se encuentra ubicada en el período 7 dentro de la tabla periódica. Cada uno de estos elementos contiene 86 electrones, que se encuentran dispuestos de forma parecida a la de los átomos del gas noble radón. Y puede disponer en los orbitales 6d y 7f de tres electrones más. Concretamente, esta serie de elementos está conformada por la inserción de un electrón más por cada uno de los elementos nuevos que le siguen, subyacente en el orbital 5f.

La serie de los actínidos, se encuentra ubicada en el período 7 dentro de la tabla periódica
Sin embargo, en los orbitales 6d y 7s, se encuentran principalmente los electrones de valencia. Por esta razón, el único electrón profundo en la nube electrónica es la diferencia entre los átomos de cada uno de los actínidos. No obstante, este electrón que los diferencia afecta realmente las propiedades químicas de los elementos de esta serie en una pequeña escala dada su ubicación en la capa quinta. Por su parte, los electrones del orbita 5f no participan en la formación de enlaces químicos con otros átomos.
Propiedades químicas de los actínidos
Los actínidos, pueden formar tres tipos de enlaces o uniones químicas en cuanto a estructura y efectos en la formación de dichos enlaces. El primero de ellos es el enlace iónico. En donde los electrones de valencia mutan del átomo menos electronegativo al mayor. Generando cargas de signo opuesto, que producen atracción por esta diferencia de carga.
Los actínidos, pueden formar tres tipos de enlaces: iónico, covalente y metálico.
El segundo enlace es el covalente, donde cada átomo comparte un par de electrones. La tercera y última unión es la metálica, donde los electrones se mueven por la estructura por la disposición de átomos. Estos enlaces de átomos se pueden representar con diversas fórmulas: molecular, estructural y general.

