Todos sabemos que los estados de la materia son líquidos, sólidos y gaseosos y pueden reconocerse por medio de sus características clave. Los sólidos tienen una fuerte composición de atracción molecular, lo que les da forma y masa. Los líquidos toman la misma forma de su contenedor, ya que sus moléculas se mueven. Mientras que los gases se difunden en el aire, ya que las moléculas están libres. Pero las características de los gases son muy distintas, por lo que aquí nos enfocaremos en diferenciar el gas real y el gas ideal.
Hay gases que son tan fuertes que pueden simplemente que pueden reaccionar con otra materia. Algunos tienen un olor muy fuerte o incluso pueden disolverse en agua. Cabe destacar que, por un lado el comportamiento de los gases reales es muy complejos, mientras que el gas ideal es más simple. De hecho, el comportamiento del gas real podría ser más tangible si se comprende por completo el comportamiento del gas ideal.
¿Qué es un gas o gas real?
El gas real es un gas que no tiene un comportamiento de acuerdo a la teoría cinético-molecular. Sin embargo, con las condiciones de presión y temperatura que pueden encontrarse en un laboratorio. Los gases reales se pueden comportar de una forma muy parecida a los gases ideales.
¿Qué es un gas ideal?
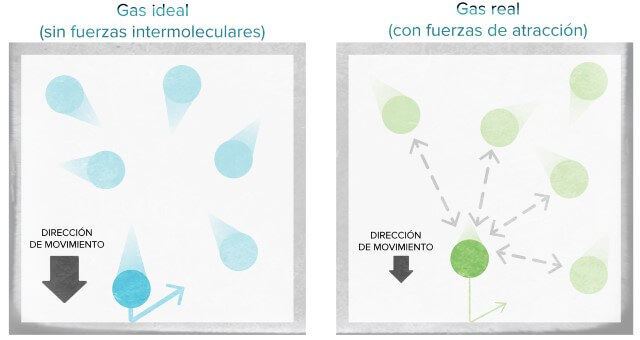
Por otro lado, el gas ideal es el que cumple con todas las leyes de gas en cualquier condición de presión y temperatura. Para esto, el gas debe cumplir en su totalidad con la teoría cinética-molecular. Por lo que las partículas deben ocupar un volumen cero y no mostrar fuerza atractiva entre sí.
Gas ideal vs gas real.
Gas real vs gas ideal
El gas ideal se puede considerar como una masa puntual, ya que la partícula es muy pequeña y su masa es casi cero. Por este motivo, la partícula del gas ideal no tiene volumen.
Por otro lado, la partícula de gas real si tiene un volumen real ya que sus partículas están formadas por moléculas o átomos que ocupan espacios muy pequeños.
En el gas ideal, la colisión o impacto entre partículas es elástico. Es decir, no hay ninguna clase de energía de atracción o repulsión en este gas. Debido a que no hay energía entre las partículas, las fuerzas cinéticas no tienen cambios en las moléculas del gas.
Mientras que las colisiones de partículas de los gases reales no son elásticas. Ya que los gases reales están formados por moléculas o partículas que se atraen entre sí con mucha fuerza debido a la energía repulsiva o atractiva. Como por ejemplo, el amoníaco, el vapor de agua, dióxido de azufre, etc.
La presión es mucho mayor en un gas ideal que en un gas real. Ya que no hay fuerza atractiva que haga que las moléculas se retengan al chocar en un impacto. Por lo que estas partículas chocan con menos energía.
En resumen, las diferencias más distinguidas entre un gas real y un gas ideal se consideran cuando la presión es alta, las partículas de gas son grandes, la temperatura es baja y las moléculas de gas tienen una gran fuerza atractiva.

