La ciencia, ha sufrido grandes transformaciones desde sus inicios con las investigaciones hechas por antiguas civilizaciones. En cuanto a la composición de la materia, fueron surgiendo teorías y tesis sobre lo que hoy conocemos como el átomo. Sin embargo, no es hasta 1913 cuando un científico danés llamado Niels Bohr establece un modelo atómico contundente. En él, se tenía la representación del átomo a manera de un núcleo pero rodeado de cargas positivas y negativas. Como las de los electrones, que trazaban orbitas circulares alrededor del núcleo. Esta teoría es conocida como el átomo de Bohr o teoría atómica. A continuación, conoceremos los detalles.
Índice
Átomo de Bohr
Modelo atómico Rutherford-Bohr
Bohr, logró mejorar ciertos elementos del modelo atómico previo de Rutherford que presentaban ciertas dificultades. Este modelo, dejaba establecido que todos los átomos poseían una estabilidad constante. Pero, se afianzaba en ciertos problemas surgidos a través de la mecánica clásica. Lograba predecir que cada electrón, podría liberar energía o radiación electromagnética al instante de orbitar su núcleo. Generando consigo, un colapso en el núcleo producto de dicha perdida de energía mientras giraba hacia su parte interna.
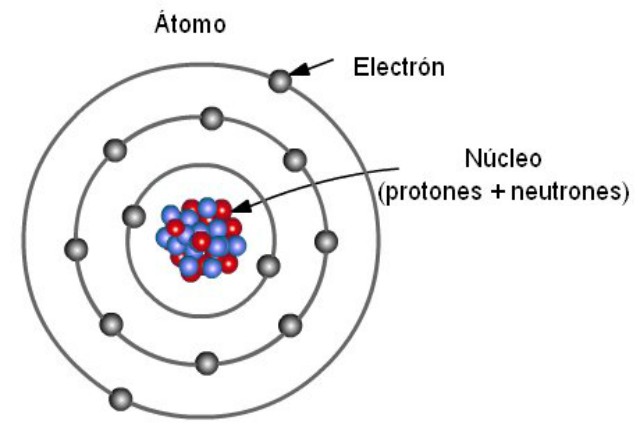
Características del modelo atómico de Bohr
Bohr fundamento su teoría de acuerdo a los modelos existentes en la época. Sobre todo, los establecidos por Rutherford pero con basamentos en las ideas de Einstein. Quien a su vez, fue el único que las incorporó a la teoría cuántica. La característica principal del modelo de Bohr, era la absorción o emisión de energía cada vez que los electrones cambiaban de orbitas permitidas. Estos, coexisten con los niveles de energía mientras rodean el núcleo. Hay que destacar, que los electrones son descritos a través de números cuánticos. Y que para que estos puedan alcanzar un movimiento, debe existir suficiente energía.
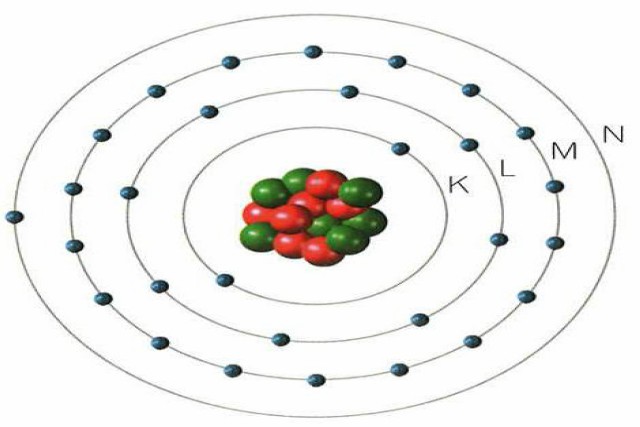
En niveles diferentes de energía, existen los electrones rodeando al núcleo. Esta energía, es denominada quantum. Y se define, como la cantidad necesaria para que un electrón pueda pasar a otro nivel. En caso de que el nivel de energía sea muy bajo, se le llama estado fundamental.
Basamentos del modelo
Fundamentado en tres postulados, Bohr entregó un legado de grandes descubrimientos:
- Estableció que los electrones se mantenían girando alrededor del núcleo, dibujando círculos en órbitas sin la irradiación de energía. Teniendo como una constante, el momento angular orbital.
- No eran posibles todas las órbitas para un electrón. Sin embargo cuando lograba una órbita permitida, podía alcanzar una energía suficiente para un estado específico y constante.
- Era a través de la absorción y emisión de energía, que un electrón podía sufrir un cambio de órbita estacionaria a otra órbita.
Aportes de la teoría atómica
A partir de los aportes de la teoría del átomo de Bohr, se logró estructurar de manera detallada la tabla periódica de los elementos. Dejando constancia, que las diferentes propiedades químicas de cada uno de ellos van en función de sus características de enlace de la carga de valencias. Todos estos estudios, dieron origen a la química cuántica.